构造论/ MEKK4
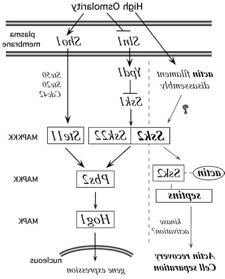

Ssk2p是MAP激酶或MEK激酶家族的丝氨酸/苏氨酸激酶. 在酵母, 它参与MAP激酶级联的信号转导称为HOG通路,代表 H本 Osmolarity G成长,在右边卡通. 这种激酶在哺乳动物细胞中保守,被称为MEKK4或MTK1,它参与p38应激反应MAP激酶途径. 酵母中HOG通路的功能是介导细胞对外部渗透压升高的反应. 所有细胞必须保持稍高的内部渗透压,以促进水的吸收和膜运输. 当酵母经历外部渗透压升高时, HOG MAP激酶途径被激活,最终导致Hog1p的磷酸化/激活, 一种改变基因表达程序的转录因子. 一些被Hog1激活的关键基因包括甘油合成的调节因子,导致细胞内甘油的积累, 酵母细胞的主要渗透保护/平衡剂. 除了激活HOG通路, 渗透应激引起细胞周期阻滞和肌动蛋白细胞骨架去极化. 我们实验室感兴趣的是这种反应的后一个方面.
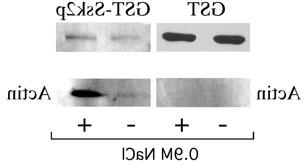

Ssk2p被认为只是传递HOG通路的激酶级联信号,但我们发现它在渗透胁迫反应的恢复阶段调节肌动蛋白细胞骨架的再极化中具有额外的作用. 当我们发现Ssk2p与肌动蛋白形成复合体时,这一点变得明显,最初是在双杂交实验中发现的,但随后通过gst下拉实验证实了这一点,如图所示.
除了与肌动蛋白形成复合体, Ssk2p在渗透胁迫细胞中重新分布到极化生长的部位. 在非应激细胞中,它均匀分布在整个细胞质中,但在渗透损伤后,它立即集中在芽和颈部皮层,如下图所示. 我们发现肌动蛋白分解(Latrunculin A处理)也能诱导这种重新分布,这使我们得出结论,Ssk2p的定位和肌动蛋白结合是由伴随渗透胁迫的肌动蛋白分解调节的. 这个模型被一个独特的Ssk2突变体所证实,我们称之为Ssk2?LD突变, 在Ssk2p的n端调控域中缺乏一个高度保守的短序列. 这个序列如下所示. 的ssk2?在渗透胁迫细胞中,LD突变体在胞浆中保持均匀分布,不能与肌动蛋白形成复合物.
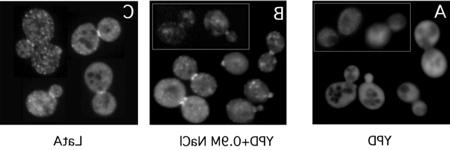
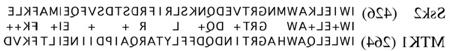

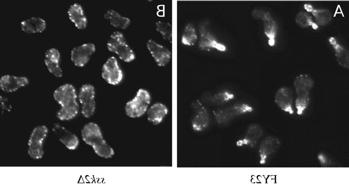

如上所述,渗透胁迫后肌动蛋白的有效恢复需要Ssk2p. 在没有Ssk2p的情况下, 细胞需要更长的时间来重新极化它们的肌动蛋白细胞骨架,并且这样做是不同步的,导致细胞生长和分裂的恢复延迟更长. 右图显示同步细胞受到渗透胁迫90分钟后肌动蛋白丝的罗丹明-phalloidin染色. 野生型细胞具有极化的肌动蛋白丝,并开始形成一个新的子细胞,而野生型细胞则删除了肌动蛋白丝 ssk2 基因都没有做到. 鉴于酵母Ssk2p和哺乳动物mtk1 /MEKK4之间的高度序列保守性, 我们想知道人类激酶是否能在酵母细胞中发挥Ssk2p的功能.
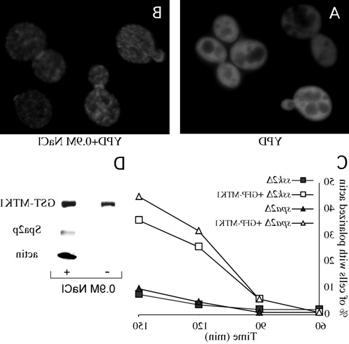

为了做这个实验,我们在酵母细胞中表达MTK1 SSK2 并观察MTK1定位(作为GFP)融合, 肌动蛋白从渗透胁迫中恢复以及与Ssk2p结合伙伴结合的能力. 如图所示, MTK1执行了Ssk2p的所有肌动蛋白特异性功能,这使我们得出结论,MTK1/MEKK4可能在应激的哺乳动物细胞中类似地调节肌动蛋白.
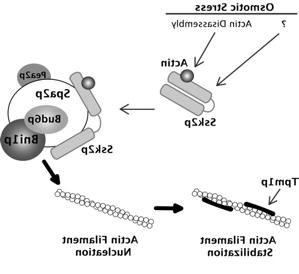
我们关于Ssk2p的出版物中提供的其他数据, 表明该激酶通过调节一种叫做极化体的蛋白质复合体来调节肌动蛋白的恢复. 极化体包括与双胍蛋白Bni1p及其调节辅助因子Bud6p/Aip3p相关的大支架蛋白Spa2p, 我们实验室的另一个重点. 这种复合物的功能是在细胞皮层的极化生长部位形成肌动蛋白结构. 总的来说,我们的观察结果支持下面卡通化的模型. 渗透胁迫诱导的肌动蛋白分解导致可用肌动蛋白单体的大量增加,其中一些与激酶的调节结构域结合. 肌动蛋白结合“打开”激酶,使其与支架蛋白Spa2p结合. 与Spa2p结合使Ssk2p靠近formin Bni1p, Bni1p随后被Ssk2p上调,导致肌动蛋白组装增强. 这些肌动蛋白丝随后被原肌球蛋白稳定,从而形成极化肌动蛋白索,恢复极化细胞生长.
Amberg实验室的出版物 SSK2:
- Yuzyuk T, Foehr M和Amberg DC. MEK激酶Ssk2p促进渗透胁迫后肌动蛋白细胞骨架的恢复. (2002) Molec. 医学杂志. 细胞.; 13: 2869-2880.
- Yuzyuk T和Amberg DC. 在渗透胁迫的细胞中,肌动蛋白的恢复和芽的出现需要保守的肌动蛋白与丝裂原活化蛋白激酶激酶Ssk2p/MTK1和支架蛋白Spa2p相互作用. (2003) Molec. 医学杂志. 细胞.; 14: 3013-3026.
- Bettinger BT, Clark MG和Amberg DC. ssk2p介导的肌动蛋白从渗透胁迫中恢复对极化体和双胍功能的要求 酿酒酵母. (2007) 遗传学; 175: 1637-1648.
- Bettinger BT和Amberg DC. MEK激酶MEKK4/Ssk2p促进了不同系统应激信号反应的复杂性. (2007) J. 细胞. 物化学., 5月1日,101(1):34-43吗.
